熱中症予防の補水について
Rehydration to prevent heatstroke

熱中症の予防方法の一つとして補水することは、すでに、国民の共通認識ですが、熱中症の場合は、補水といってもただ水やスポーツドリンクを飲めば良いわけでなく、体の細胞にちゃんと補水してくれるものを飲む必要があります。
そこで、今回は、国民の共通認識となりつつある補水についてフォーカスしてみます。
そこで、補水といえば経口補水液がイメージされるので、経口補水液についてフォーカスしてみました。
経口補水液の歴史
下痢の症状がある場合は、大腸で水分吸収などが充分にされないので便がゆるゆるな状態になり、さらに電解質の喪失も起こってしまいます。ところが、小腸でナトリウムとブドウ糖が吸収される際、これに伴って水も吸収される仕組み(共輸送系)が発見され、ブドウ糖と食塩を同時に与えれば、通常の水分吸収の大部分を担う大腸ではなく、小腸から水分を効率的に補給できることが分かり、これが経口補水液の発明につながりました。
医学的にはこれを経口補水療法といい、英語では、oral rehydration therapy(以下ORTと略します)といいます。
ORTは1945年に初めて報告されました。その当時は高い糖濃度の経口補水液(Oral Rehydration Solution以下ORSと略します)であったため、高ナトリウム血症が多数報告されて行われなくなってしまいました。
そして、1960年代には、コレラによる脱水の治療において、改良されたORSと経静脈輸液は同等の効果を持つことが示され、コレラによる腸炎では、食塩水とブドウ糖の混合液は80%吸収し、ORSが効果を発揮する上ではナトリウム‐グルコース共輸送が重要であると考えられました。
当時,世界保健機関(world health organization 以下WHOと略します)はORSの組成をNa 90mEq/Lと高く設定していましたが、ORSの浸透圧を下げると下痢も減るため、浸透圧を311mOsm/Lから245mOsm/Lに、ブドウ糖を111mmol/Lから75mmol/Lに、Naを90mEq/Lから75mEq/Lにして、ナトリウムとブドウ糖の比率を1:1としました。
現在は、ナトリウムとブドウ糖の比率は1:1~2が推奨され、米国小児科学会(American Academy of Pediatrics 以下AAPと略します)は1:1~2を超えないように勧告しています。
ちなみに、経口補水液として有名な◯ーエ◯ー1は、WHOの提唱する経口補水療法の考え方に基づいた飲料で、その組成は、経口補水療法を発展させたAAPの指針に基づいています。
経口補水液は自分でも簡単にできる!
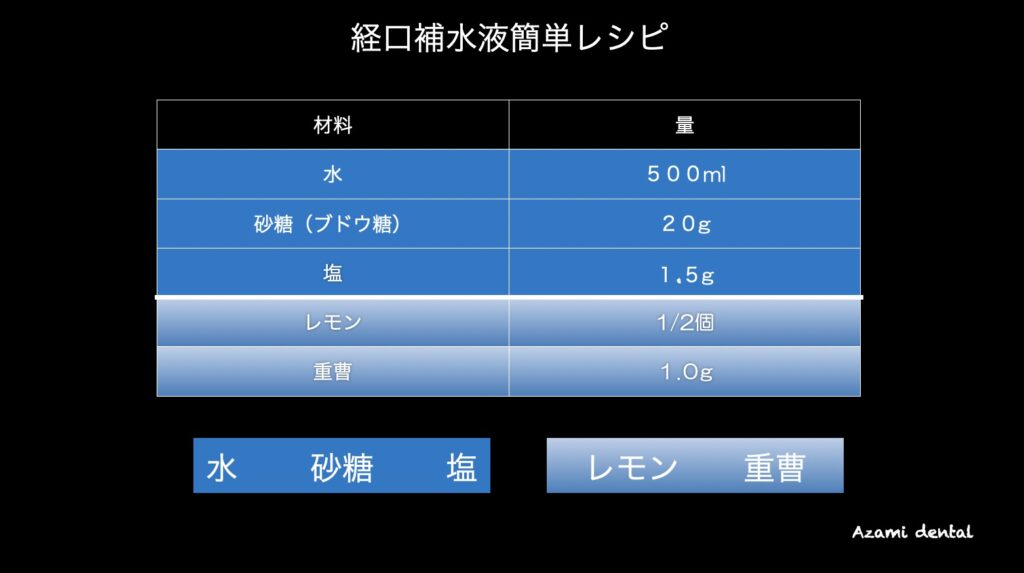
基本的には、「水」と「ブドウ糖」と「食塩」だけで家庭で簡単に作ることが出来ます。
発展途上国では、「コップ1杯の沸騰したお湯に、ひとつまみの塩と一握りの砂糖を入れる」ことで簡易的な経口補水液を作って使用しています。
ただし、この方法で作った経口補水液を頻繁に飲んでいると糖があるのでむし歯になってしまいます。また、レモン(pH2)を入れると酸性になるのでさらにむし歯が心配になります。そんな時は重曹(炭酸水素ナトリウム)を入れることをお勧めします。
歯が溶けるpHは5.5なので、重曹を入れることによってアルカリに傾くからです。
ところで、レモン水に重曹を入れると泡が発生します。この泡は、二酸化炭素で、昔の炭酸水の作り方です。
ちょっと余談ですが、重曹の化学式はNaHCO3 日本語では「炭酸水素ナトリウム」ですが、「重炭酸ナトリウム」あるいは「重炭酸ソーダ(重炭酸曹達)」とも言います。
呼び名が違うのはドイツ語と英語と日本語がごちゃごちゃで使われているからです。
ナトリウムはドイツ語で「ナトリウム(natrium)」、英語になると「ソディウム(sodium)」となり、ナトリウムが何かと結合して「ナトリウム化合物」になると、英語で「ソーダ(soda)」と言います。
重曹(sodium bicarbonate, sodium hydrogen carbonate)、つまり炭酸水素ナトリウムは炭酸ナトリウムより比重が重いという特徴があるので「重い炭酸ナトリウム(ソーダ)」といい、これを日本語で「重炭酸曹達」で表記し、さらに、これを略して「重曹」としました。
経口補水液はいつ摂取すればよいのか?
基本的には、脱水症状が現れた時に摂取することになります。
大量の汗をかいた場合に摂取しても問題ないとされていますが、電解質の濃度が高く設定されているので、ナトリウム、カリウムの制限を受けている方は注意が必要です。
摂取する場合は、
感染性腸炎、感冒による下痢、嘔吐・発熱を伴う脱水状態、高齢者の経口摂取不足による脱水状態、過度の発熱による脱水状態等に適しているとされています。
経口補水液は予防的に飲むのではない!
1日に飲料として摂取する水分は、1.2Lが目安とされています。また、大量の汗をかいた場合は、水分だけでなく一緒に塩分の摂取が必要です。
ちなみに、軽い脱水状態の時に、喉の渇きは感じないといわれています。そこで、喉の渇きがある前、あるいは発汗が予想される時はあらかじめ水分を補給しておくことをお勧めします。
また、1日の補水回数は8回を目安にこまめに補水することが推奨されています。つまり1回に150mlを飲むことになります。おおよそコップ一杯です。ちなみに予防的に飲むものは、普通の水で問題ありません。
経口補水液は、ナトリウムやカリウムの濃度が高いので予防的に飲むものではありません。大量に汗をかいた場合は、飲んでも良いとされていますが、もしお飲みになる場合はあらかじめ医師との相談をしてください。
経口補水液とむし歯
経口補水液は、ブドウ糖約2%、 pHは3.8なので、ミュータンス菌を保有していれば、頻繁に飲むとスポーツドリンク(スポーツドリンクについてを参照してください)と同様にむし歯になる可能性があります。
糖が含まれている飲料を飲む場合は、飲んだ後にうがいをすることにより口腔内の唾液のpHがベースラインに早く戻るので、歯が脱灰されにくくなります。要するにむし歯になりにくくなるということです。
糖を含んだものを飲んだ時は、うがいをすることをお勧めします。
まとめ
1日8回を目安にこまめに補水
熱中症予防の補水は普通の水で十分
経口補水液は脱水症状が出た場合に使用
経口補水液も飲んだ後はうがいを
前提知識
溶質・溶媒・溶液

用語の復習です。これは、中学の化学で習いましたねエ😃
濃度の話をする場合は「溶質」「溶媒」「溶液」のワードの認識が必要です。
「溶質」→液体に溶けている物質
「溶媒」→溶質を溶かしている液体
「溶液」→溶質が溶媒に溶けた液全体
食塩水を例にしてみると、食塩水は溶液、水は溶媒、食塩は溶質になります。水の溶液を水溶液と言います。
濃度の単位

濃度を表す単位には、「パーセント(%)濃度」「モル(mol)濃度」「ミリ当量(mEq/L)」などがあります。
「%濃度」は、日常で使っているのであまり説明の必要はありませんが、%の数値がそのままg数になります。
例えば、経口補水液のブドウ糖が2%だとしたら100mLに2g含まれていることになります。500mlのペットボトルなら10gブドウ糖が含まれていることになります。
「mol濃度」は、日常ではほとんど使用しません。高校の化学の授業で習うものです。
mol/Lは、溶液1Lに溶けている物質のモル数を表します。1モルの重さは、その物質の原子量または分子量のグラム数を表します。
例えば、生理食塩水のNaClのモル濃度はどのぐらいなのか?
生理食塩水は濃度が0.9%なので、1L中に9gの食塩が溶解していることになります。
食塩つまりNaClの1モルの質量は、58.5gなります。NaCl(58.5g)→Na+(23.0g)+Cl–(35.5g)
生理食塩液は1L中に9gの食塩が溶解しているので、9/58.5=0.154mol/L
生理食塩水のNaClのモル濃度は、0.154mol/Lになります。(この数値は、後ほど、mEq/Lの項で触れるのでなんとなく覚えておいてください)
次は、電解質の単位のmEq/Lについてですが、これには、ちょっと前提知識が必要です。
電解質と非電解質
電解質は、水に溶かすとイオン化するもので、陰イオンと陽イオンがあります。
陽イオンはNa+、K+、Ca2+、Mg2+などがあり、陰イオンにはCl–、HCO3−、HPO42-、SO42-、などがあります。
イオンの種類によって電荷の数が異なり、1価のイオンはNa+、K+、Cl–、HCO3−など、2価のイオンはCa2+、Mg2+、HPO42-、SO42-などがあります。
非電解質は、水に溶かしても電離しないもので、ブドウ糖、脂肪、尿素などがあります。
電解質の単位
電解質の単位は、mEq/L(ミックパーリットル)で表します。これは、高校の化学では習いません。医療業界で慣用的に使われてきたもので、SI単位ではないので、業界外では通じません。
mEq/Lは、溶液1Lに溶けている物質の当量数です。
体液や輸液に含まれる電解質量を表します。Eqはequivalent(イクイバレント)の略で、同じ、等しいという意味です。
mEq(ミリイクイバレント)はEqの1/1000の単位です。
イオンの電荷は、イオンの種類により異なりますが、各イオンは同じ電荷数(当量)で反応します。
mEq/Lとmol/Lの関係

濃度の単位のところで、生理食塩水のNaClのモル濃度を求めましたが、0.154mol/Lでした。これをmmol/Lにすると154mmol/Lになります。
さて、ここで問題です。Na+とCl–のmEq/Lは?
答え:それぞれ154mEq/L
Na+、Cl–はそれぞれ電荷数が1なので、154mmol/L ×1=154mEq/L となるからです。
